Пользователи протокола: неонатологи родовспомогательных организаций 3 уровня. Достоверность доказательств:
Категория пациентов: новорожденные недоношенные дети с экстремально низкой массой тела при рождении.
1.Название протокола:
Крайняя незрелость
2. Код протокола
3. Код МКБ Х:
РО7 Расстройства связанные с укорочением срока беременности и малой массой тела при рождении.
4. Сокращения, используемые в протоколе:
Er-эритроциты;
Hb-гемоглобин
Ht-гемотокрит
L-лейкоциты
АЛТ - аланинаминотрансфераза
КЩР-кислотно-щелочное основание
ИФА-иммуноферментный анализ
ПЦР – полимеразная цепная реакция
СРБ – С-реактивный белок
FiO2 – концентрация подаваемого кислорода
МВ – механическая вентиляция
NIPPV -назальная вентиляция с прерывистым положительным давлением
ОАК – общий анализ крови
ОАП – открытый артериальный проток
РДС − Респираторный дистресс синдром
РН – ретинопатия недоношенных См.
Н2О – сантиметров водного столба
СРАР - постоянное положительное давление в дыхательных путях
СУВ – синдром утечки воздуха
ТТН – транзиторное тахипноэ новорожденных Т
БИ – тяжелая бактериальная инфекция
ЧД − частота дыхания
ЧСС – частота сердечных сокращений
ЭхоКГ – эхокардиография
РН – ретинопатия новорожденных
ВЖК – внутрижелудочковое (нетравматическое) кровоизлияние
БЛД – бронхолегочная дисплазия
РКИ – рандамизированные контролируемые исследования
5. Дата разработки протокола: 2014 г.
6. Категория пациентов: новорожденные недоношенные дети с экстремально низкой массой тела при рождении.
7.Пользователи протокола: неонатологи родовспомогательных организаций 3 уровня. Достоверность доказательств:
Уровень А: рекомендации базируются на результатах систематических обзоров рандомизированных контролируемых исследований (РКИ) и обеспечивают наибольшую достоверность (Уровень 1а), тогда как рекомендации, базирующие на результатах отдельных РКИ обеспечивают более низкий уровень (Уровень2b).
Уровень В: рекомендации базируются на результатах клинических исследований, но более низкого качества, чем РКИ. Сюда включаются когортные исследования (Уровень 2а и 2 b)и исследования «случай-контроль» (Уровень 3а и 3b).
Уровень С: рекомендации базируются на результатах серии случаев или низкокачественных когортных исследований и исследований «случай-контроль» (без контрольной группы).
Уровень D: рекомендации базируется на мнение специалистов без четкой критической оценки или на знании физиологии.[5]
8. Определение: К детям с крайней незрелостью относятся новорожденные с гестационным возрастом от 22 до 28 недель и массой тела 500-999г. [4]
9. Клиническая классификация: - чрезвычайно малая масса тела при рождении - масса тела при рождении менее 1000 (от 500 до и включая 999 г); - очень малая масса тела при рождении - масса тела при рождении менее 1500 г (от 1000 г. до и включая 1499 г); - малая масса тела при рождении – масса менее 2500г. (от 1500 г до и включая 2499 г).
10. Показания для госпитализации: Экстренная госпитализация беременной женщины с преждевременными родами в стационар 3-го уровня.[4]
11.Перечень основных и дополнительных диагностических мероприятий:
11.1 Основные диагностические мероприятия [4]
А. Факторы риска: гестационный возраст менее 28 недель, сахарный или гестационный диабет у матери, кесарево сечение, кровотечение у матери во время беременности, перинатальная асфиксия, мужской пол, второй (или каждый последующий) при многоплодной беременности.
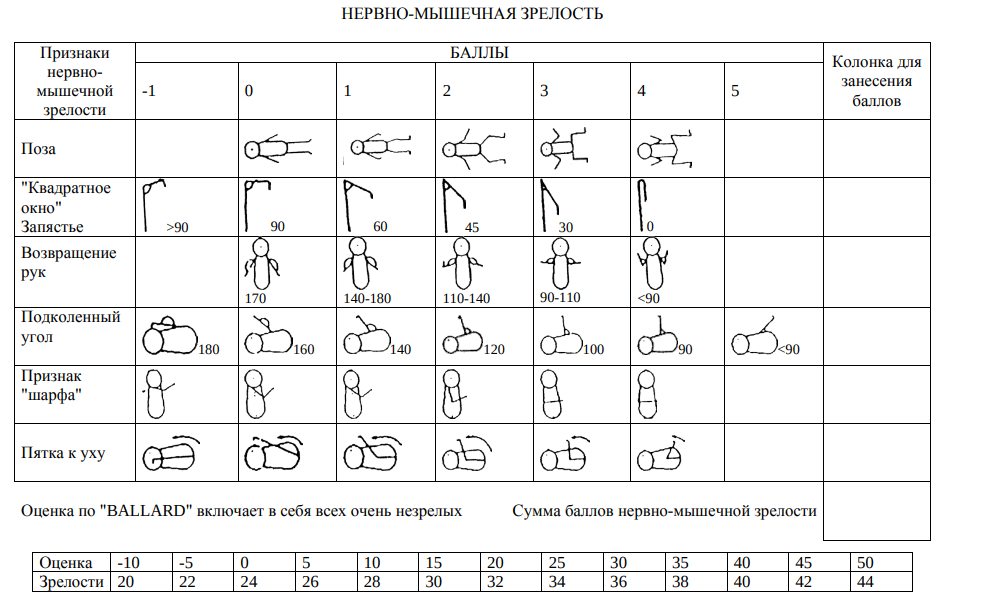
Б. Клинические проявления: Оценка нервно-мышечной и физической зрелости по Болларду, сумма баллов должна соответствовать гестационному возрасту 22- 28 недель.

ФИЗИЧЕСКАЯ ЗРЕЛОСТЬ
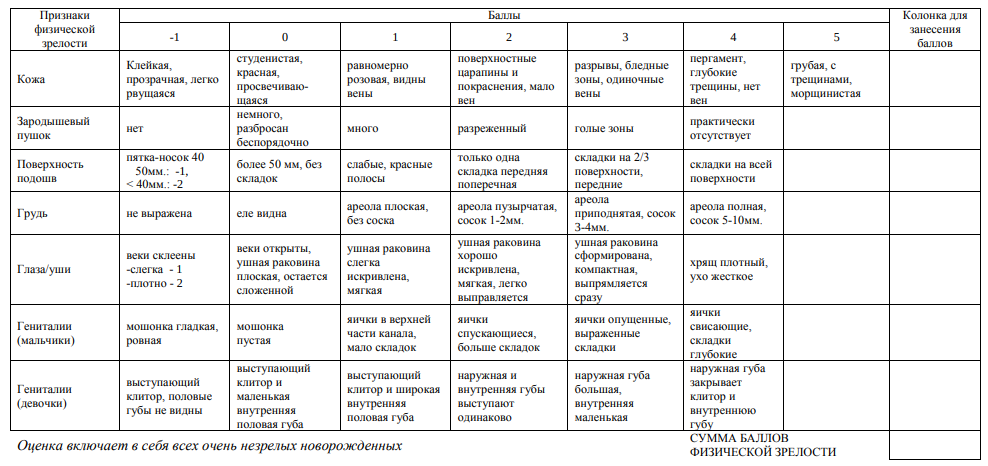
Классификация и определение степени зрелости новорожденного (обследование по Ballard). Это один из наиболее широко используемых тестов для определения гестационного возраста. Он позволяет оценивать гестационный возраст с точностью до 2 недель как у здоровых, так и больных новорожденных.
Используют 6 критериев физической зрелости и 6 критериев неврологической зрелости. Критерии неврологической зрелости основаны на том, что пассивный мышечный тонус имеет большее значение для определения гестационного возраста, чем активный тонус. Тест следует проводить в возрасте 30-42 ч в положении ребенка на спине. Нервно-мышечная зрелость
1.Поза Характер позы определяют при осмотре ребенка. 2.«Квадратное окно» Запястье с помощью большого и указательного пальцев врач сгибает кисть ребенка к предплечью. Угол между возвышенностью гипотенера и внутренней поверхностью предплечья определяется на глаз.
3. Возвращение рук Согните руку ребенка в локтевом суставе на 5 сек; затем возьмите его за кисть, полностью ее разогните и отпустите. Если предплечье вновь полностью сгибается, дается оценка
4 балла. Меньшую оценку дают в соответствии с диаграммой.
4. Подколенный угол Врач левым указательным пальцем сгибает бедро ребенка к груди, поддерживая колено большим пальцем. Затем указательным пальцем правой руки, расположенным на задней поверхности лодыжки, небольшим усилием разгибают ногу в коленном суставе. Измеряют угол в подколенном пространстве и дают соответствующую оценку.
5. Признак «шарфа» Возьмите руку ребенка за кисть и мягко потяните ее над противоположным плечом и вокруг шеи настолько, насколько это возможно. Дайте оценку согласно диаграмме.
6. Пятка к уху Удерживая таз ребенка на столе, попытайтесь без усилия привести стопу к голове насколько возможно близко. Дайте оценку согласно диаграмме. Физическая зрелость. Подробное описание признаков физической зрелости на карте. Рост пушковых волос оценивают на спине между лопаток и выше.
11.2 Дополнительные диагностические мероприятия Рентгенологические признаки для выявления РДС и другой патологии респираторной системы: Классическая картина РДС /пневмонии, ВПС и др.
12.Диагностические критерии.
4] А. Лабораторные показатели − Газы крови: уровень РаО2 менее 50 мм ртутного столба (менее 6,6 кПа). − Бакпосев крови, СРБ, ОАК для исключения ТБИ (пневмония, сепсис, менингит).
Б. ЭхоКГ: для исключения ВПС, обнаружения ОАП, легочной гипертензии и уточнения направления шунтирования крови.
В.Дифференциальный диагноз: ТТН, СУВ, пневмония, сепсис. Сроки первичного скрининга РН
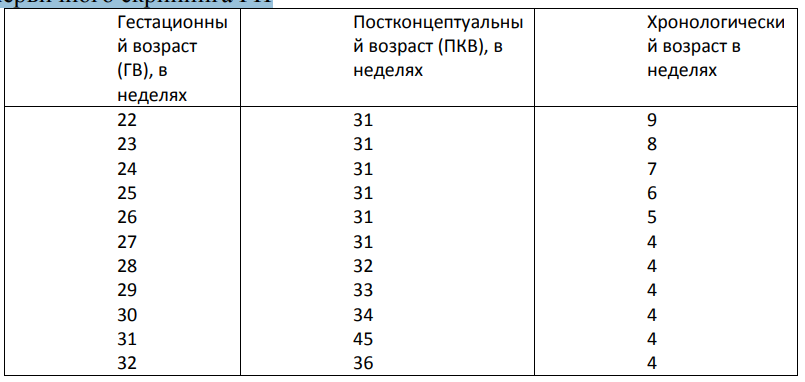
13. Цель лечения: обеспечение вмешательств, способствующих максимизации числа выживших недоношенных детей при одновременном снижении потенциальных побочных эффектов. 14. Тактика лечения [4] В зависимости от выявленной патологии (см. Соответствующие протоколы РДС).
14.1 Тактика ухода В родильном зале:
Стабилизация состояния младенца с крайней незрелостью после рождения. Согласно современным рекомендациям следует применять более мягкие подходы к проведению первоначальной респираторной поддержки и поэтому использование термина «стабилизация» более предпочтительно, чем термин «реанимация» [1].
А.Необходимые условия для адекватной стабилизации новорожденного:
• При рождении ребенка из группы риска по развитию РДС на роды вызываются наиболее подготовленные сотрудники, владеющие современными знаниями и навыками проведения реанимации у новорожденных с чрезвычайно малой и очень малой массой тела при рождении.
• Для поддержания оптимальной температуры воздуха в родовой палате (25-26ºС) могут использоваться дополнительные обогреватели, источники лучистого тепла, открытые реанимационные системы. Для исключения перегрева, необходимо проводить сервоконтроль в пределах 10 мин [B].
• Согревание и увлажнение газов, использующихся для стабилизации состояния, также может помочь поддержать нормотермию.
Для профилактики гипотермии новорожденных с гестационным возрастом менее 28 недель следует сразу после рождения помещать в пластиковый мешок или использовать пленку для окклюзионного обертывания с параллельно включенным обогревателем [A].
• Неконтролируемые объемы вдоха, как завышенные, так и заниженные, могут быть опасными для незрелых легких недоношенных детей. Поэтому традиционное использование саморасправляющегося мешка рекомендуется заменить на реанимационную систему с Т-образным коннектором, что обеспечивает контроль заданного постоянного положительного давления в воздухоносных путях (СРАР) с замеряемым пиковым давлением на вдохе (PIP) при закрытии тройника. Б.Стабилизация состояния новорожденного после рождения Сразу после рождения закрепить пульсоксиметр на запястье правой руки новорожденного для получения информации о ЧСС и целевых показателях сатурации [B].
Зажим пуповины у недоношенного новорожденного, если позволяет его состояние, рекомендуется отложить на 60 секунд, с положением младенца ниже матери, чтобы способствовать плаценто-плодовой трансфузии [А].
Недоношенным новорожденным с гестационным возрастом менее 26 недель, когда FiO2 составляет > 0,30, а для новорожденных со сроком гестации до 28 недель, при FiO2 > 0,40 [B] необходима интубация для ведения в родильном зале сурфактанта. После введения сурфактанта следует принять решение о немедленной (или ранней) экстубации (методика INSURE: INинтубация –SUR-сурфактант–E-экстубация) с переходом на неинвазивную вентиляцию (СРАР или назальную вентиляцию с перемежающимся положительным давлением ─ NIPPV), но при условии стабильности в отношении других систем новорожденного [В]. Назальную вентиляцию с прерывистым положительным давлением (NIPPV) можно рассматривать в качестве средства для снижения риска неудачной экстубации у младенцев, которым не помогает CPAP, однако такой подход не дает значительных долгосрочных преимуществ [A].
• Нормальная сатурация сразу после рождения для недоношенного ребенка составляет 40-60%, повышается до 80% к 5-й минуте и должна достигнуть 85% и более к 10-й минуте после рождения. Во время стабилизации следует избегать гипероксии [В].
• При необходимости ведения кислорода он должен подаваться только через кислородно-воздушный смеситель. Для начала стабилизации целесообразна концентрация кислорода 21-30%, а увеличение или снижение его концентрации производится на основании показаний пульсоксиметра о ЧСС и сатурации [B]
• Для лечения РДС порактант альфа в начальной дозе 200 мг/кг лучше, чем 100 мг/ кг того же препарата или берактанта [A].
•Должна вводиться вторая, а иногда и третья доза сурфактанта, если сохраняются признаки РДС – такие, как постоянная потребность в кислороде и необходимость проведения механической вентиляции [A]. 14.2 Дополнительная оксигенотерапия после стабилизации состояния новорожденного:
• при проведении оксигенотерапии недоношенным новорожденным после начальной стабилизации уровень сатурации кислородом должен поддерживаться между 90-95% [В];
• после введения сурфактанта необходимо быстро снижать концентрацию подаваемого кислорода (FiО2) для предупреждения гипероксического пика [C];
• чрезвычайно важно избегать колебаний сатурации в постнатальном периоде [С]. 14.3. Стратегия механической вентиляции (МВ) легких.
• МВ необходимо использовать для поддержки новорожденных с дыхательной недостаточностью, у которых назальный СРАР не дал эффекта [В].
• МВ может осуществляться посредством традиционной вентиляции с перемежающимся положительным давлением (IPPV) или высокочастотной осцилляторной вентиляции легких (HFOV). HFOV и традиционная IPPV обладают аналогичной эффективностью, поэтому следует применять метод вентиляции, наиболее эффективный в каждом конкретном отделении.
• Целью МВ является поддержание оптимального объема легких после раскрытия путем создания адекватного положительного давления в конце выдоха (РЕЕР), или постоянного расправляющего давления (CDP) на HFOV на протяжении всего респираторного цикла.
• Для определения оптимального PEEP при традиционной вентиляции, необходимо пошагово изменять PEEP с оценкой уровней FiO2, CO2 и наблюдения за механикой дыхания. • Следует использовать вентиляцию с целевым объемом вдоха, так как это сокращает продолжительность вентиляции и снижает БЛД [А].
• Следует избегать гипокапнии, поскольку она связана с повышенным риском бронхолегочной дисплазии и перивентрикулярной лейкомаляции.
• Настройки МВ должны чаще регулироваться для обеспечения оптимального объема легких.
• Прекращение МВ с экстубацией и переводом на СРАР необходимо осуществлять в как можно более ранние сроки, в том случае, если это клинически безопасно и концентрации газов крови приемлемы [В]
• Экстубация может быть успешной со среднего давления воздуха 6–7 см H2O на традиционных режимах и с 8–9 см H2O ОВЧВ, даже у самых незрелых детей. 14.4 Исключение или сокращение продолжительности механической вентиляции легких.
• Необходимо отдавать предпочтение СРАР или NIPPV, чтобы избежать или сократить продолжительность инвазивной механической вентиляции [В].
• При отлучении от МВ допускается умеренная степень гиперкапнии, при условии, что рН сохраняется на уровне выше 7,22 [В].
• Для сокращения продолжительности МВ необходимо использовать режимы традиционной вентиляции с синхронизированным и заданным объемом дыхания с применением агрессивного отлучения от аппарата [В].
• Кофеин должен входить в схему лечения апноэ у новорожденных и для облегчения экстубации [А], а также кофеин может использоваться для детей с массой тела при рождении менее 1250 г, находящихся на СРАР или NIPPV и имеющих вероятность возникновения потребности в инвазивной вентиляции [В]. Кофеин цитрат вводится в дозе насыщения 20 мг/кг, далее 5-10 мг/кг/сутки – поддерживающая доза.
14.5. Профилактика инфекций.
Рекомендации
• Всем новорожденным с РДС следует начинать лечение антибиотиками до полного исключения возможной реализации тяжелой бактериальной инфекции (сепсис, пневмония). Обычная схема включает комбинацию пенициллин/ампициллин с аминогликозидом. В каждом неонатальном отделении должны разрабатываться собственные протоколы по использованию антибиотиков, основанных на анализе спектра возбудителей, вызывающих ранний сепсис [D].
• Лечение антибиотиками следует прекратить как можно быстрее, как только будет исключена реализация ТБИ [С].
• В отделениях с высокой частотой инвазивных грибковых инфекций рекомендуется проводить профилактическое лечение флуконазолом у детей с массой тела при рождении менее 1000 г или с гестационным возрастом ≤ 27 недель, начиная с 1-го дня жизни в дозе 3мг/кг два раза в неделю в течение 6 недель [А].
14.6. Поддерживающий уход У новорожденных с РДС наилучший исход обеспечивается оптимальным поддержанием нормальной температуры тела на уровне 36,5-37,5ºС, лечением открытого артериального протока (ОАП), поддержкой адекватного артериального давления и тканевой перфузии. Инфузионная терапия и питание
• Большинству недоношенных новорожденных должно быть начато внутривенное введение жидкостей по 70-80 мл/кг в день, с поддержанием повышенной влажности в инкубаторе [D].
• У недоношенных объем инфузии и электролитов должен рассчитываться индивидуально, допуская 2,4-4% потери массы тела в день (15% в общем) в первые 5 дней (D).
• Прием натрия должен быть ограничен в первые несколько дней постнатальной жизни и начат после начала диуреза с внимательным мониторингом баланса жидкости и уровня электролитов [В].
• Парентеральное питание следует начинать с 1-го дня во избежание замедления роста и предусмотреть раннее введение белков, начиная с 3,5 г/кг/день и липидов 3,0 г/кг/день для поддержания должного количества калорий. Такой подход улучшает выживаемость недоношенных с РДС [А]
• Минимальное энтеральное питание также следует начинать с первого дня (В).
Б. Поддержание тканевой перфузии
• Концентрации гемоглобина должны поддерживаться в пределах нормального диапазона значений. Предполагаемое пороговое значение концентрации гемоглобина у новорожденных, находящихся на вспомогательной вентиляции, составляет 120 г/л в 1-ю неделю, 110 г/л во 2-ю неделю и 90 г/л после 2 недели постнатальной жизни.
• Лечение артериальной гипотензии рекомендуется проводить, если она сопровождается доказательствами низкой перфузии тканей [С].
• Восполнение ОЦК при гипотензии рекомендуется проводить 0,9% раствором хлорида натрия по 10-20 мл/кг, если была исключена дисфункция миокарда [D].
• Если восстановлением ОЦК не удается удовлетворительно повысить давление крови, необходимо ввести допамин (2-20 мкг/кг/мин) [В].
• Если сохраняется низкий системный кровоток, или есть необходимость лечения дисфункции миокарда, необходимо использовать добутамин (5-20 мкг/кг/мин) в качестве препарата первой линии и эпинефрин (адреналин) в качестве препарата второй линии (0,01-1,0 мг/кг/мин).
• В случаях рефрактерной гипотензии, когда традиционная терапия не дает эффекта, следует использовать гидрокортизон (1 мг/кг каждые 8 часов).
• Эхокардиографическое исследование может помочь в принятии решения относительно времени начала лечения гипотензии и выбора лечения [В]. В. Лечение открытого артериального протока. • Если принимается решение о медикаментозном лечении ОАП, то использование индометацина и ибупрофена оказывает одинаковый эффект [В], однако ибупрофен ассоциируется с более низкой степенью побочных эффектов со стороны почек.
• Фармакологическое или хирургическое лечение ОАП должно основываться на индивидуальной оценке клинических признаков и эхографических показаний (D). • Профилактическая перевязка ОАП в течение 24 часов после рождения повышает риск развития бронхолегочной дисплазии [А]. Г. Другие аспекты лечения
• Ингаляционная терапия оксидом азота не обладает преимуществами при лечении недоношенных детей с РДС [А].
• Терапия сурфактантом может применяться для улучшения оксигенации после легочного кровотечения, однако долгосрочные благоприятные эффекты отсутствуют [С].
• Заместительная терапия сурфактантом при прогрессирующей БЛД приводит только к кратковременным благоприятным эффектам и не может быть рекомендована [С]. Д. Профилактика РДС
Рекомендации
• Беременные женщины с высоким риском преждевременных родов должны госпитализироваться в перинатальные центры [С].
• Преждевременные роды, в случае дородового разрыва плодного пузыря, могут быть отсрочены назначением антибиотиков [А] и токолитиков [А], что обеспечит выигрыш во времени для транспортировки беременной в перинатальный центр с плодом in utero и проведение стероидной терапии для профилактики РД
• Рекомендуется проводить однократный курс антенатальных кортикостероидов всем женщинам с риском преждевременных родов с гестационным сроком от 23 недель до 34 полных недель беременности [A].
Могут использоваться 2 схемы пренатальной профилактики РДС:
• бетаметазон 12 мг внутримышечно, через 24 часа, всего 2 дозы на курс или
• дексаметазон – 6 мг внутримышечно, через 12 часов, всего 4 дозы на курс.
• Повторный курс антенатальных стероидов может быть уместным, если первый курс был проведен более 2-3 недель назад, а гестационный возраст ребенка составляет менее 33 недель и при этом возникает другое акушерское показание [A].
• Прием антенатальных стероидов должен также рассматриваться для женщин, у которых будет проводиться плановое кесарево сечение, до начала схваток в связи с наступлением срока родов [B].
15. Индикаторы эффективности лечения:
• Повышение выживаемости недоношенных с экстремально низкой массой тела
• Снижение частоты осложнений, обусловливающих инвалидизацию детей: РН, ВЖК, БЛД, тугоухость.
16. Список разработчиков:
Чувакова Тамара Курмангалиевна, д.м.н., профессор «АО ННЦМД»;
Тортаева Гульнар Сагиевна, к.м.н., «АО ННЦМД», заведующая отделением неонатологии.
17. Указание на отсутствие конфликта интересов: отсутствует.
18. Рецензенты: Джаксалыкова Куляш Каликановна, д.м.н., ГМУ города Семей, профессор.
19. Указание условий пересмотра протокола: Пересмотр протокола производится не реже, чем 1 раз в 3 года, либо при поступлении новых данных, связанных с применением данного протокола.
20.Список использованной литературы:
1) Sweet DG, Carnelli V, Greisen G, Hallman M, Ozek E, Plavka R, Saugstad OD, Simeoni U, Speer CP, Vento M, Halliday HL, European association of Perinatal Medicine: European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants − 2013 update. Neonatology 2013; 99:353-368.
2) Dunn M.S. Kaempf J., de Klerk A, de Klerk R, Reilly M, et al. Study Group: Randomized trial comparing 3 approaches to the initial respiratory management of preterm neonates. Pediatrics 2011; 128: e1069-e1076.
3) Sweet DG, Carnelli V, Greisen G, Hallman M, Ozek E, Plavka R, Saugstad OD, Simeoni U, Speer CP, Halliday HL, European association of Perinatal Medicine: European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants − 2010 update. Neonatology 2010; 97:402-417.
4) Сборник научных трудов.Научно-практическая конференция кафедры неонатологии «Внедрение новых перинатальных технологий в практику родовспоможения» ЮНИСЕФ г. Алматы – 2007г.
5) Guyatt GH et al. Users’s guides to the medical literature. IX.A method for grading health care recommendations/ Evidence-Based Medicine Working Group, JAMA, 1995,274,1800-4.
6) Международная статистическая классификация болезней и проблем связанных со здоровьем десятый пересмотр – МКБ –Х 2009г