Пользователи протокола: акушеры-гинекологи, урологи-андрологи, терапевты, эмбриологи – специалисты лаборатории ЭКО, специалисты клиникодиагностических лабораторий.
Категория пациентов: взрослые.
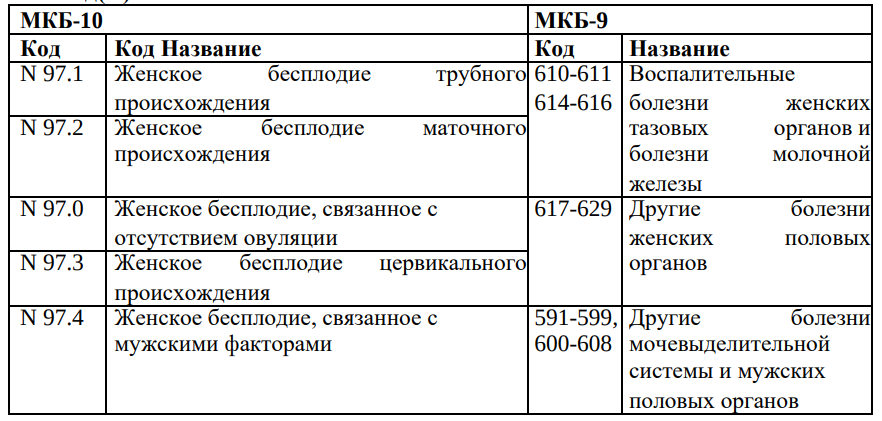
1.1 Код(ы) МКБ:
1.2 Дата разработки/пересмотра протокола: 2017год (пересмотр 2020 г.)
1.3 Сокращения, используемые в протоколе:
АЧТВ – активированное частичное тромбопластиновое время
ВИЧ – вирус иммунодефицита человека
ВПГ – вирус простого герпеса
ВХ – вспомогательный хетчинг
ГнРГ – гонадотропин-рилизинг гормон
ИКСИ – инъекция сперматозоида в цитоплазму ооцита
ЛГ – лютеинизирующий гормон
ТВП – трансагинальная пункция
ТТГ – тиреотропный гормон
УЗИ – ультразвуковое исследование
ФСГ – фолликулостимулирующий гормон
ХГч – хорионический гонадотропин человека
ЦМВ – цитомегаловирус
ЭКО – экстракорпоральное оплодотворение
ПЭ – перенос эмбрионов
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
СГЯ – синдром гиперстимуляции яичников
ант-ГнРГ – антагонист гонадотропин-рилизинг гормона
а-ГнРГ – агонист гонадотропин-рилизинг гормона
1.4 Пользователи протокола: акушеры-гинекологи, урологи-андрологи, терапевты, эмбриологи – специалисты лаборатории ЭКО, специалисты клиникодиагностических лабораторий.
1.5 Категория пациентов: взрослые.
1.6 Шкала уровня доказательности:
А Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ сочень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию.
В Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ сневысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
С Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
D Описание серии случаев или неконтролируемое исследование, или мнение экспертов. GPP Наилучшая клиническая практика.
1.7 Определение: Лечение бесплодия методом ЭКО, с антагонистами гонадотропного рилизинг гормона – это процедура стимуляции суперовуляции в программах ЭКО и ПЭ, где препаратом, блокирующим паразитарный (преждевременный) пик лютеинизирующего гормона выступает антагонист гонадотропного рилизинг гормона.
1.8 Клиническая классификация: нет.
2.1 Цель проведения процедуры/вмешательства: наступление беременности. 2.2 Показания и противопоказания для проведения процедуры/ вмешательства Показания для проведения процедуры/вмешательства:
• бесплодие, не поддающееся терапии;
• вероятность преодоления которого с помощью ЭКО выше, чем другими методами.
Противопоказания к процедуре/вмешательству:
• соматические и психические заболевания, являющиеся противопоказаниями для вынашивания беременности и родов;
• врожденные пороки развития, приобретенные деформации полости матки, при которых невозможна имплантация эмбрионов и вынашивание беременности;
• доброкачественные опухоли матки, требующие оперативного лечения, препятствующие имплантации эмбрионов; острые воспалительные заболевания любой локализации; • злокачественные новообразования любой локализации на момент начала процедуры (за исключением случаев планирования отсроченного материнства).
2.3 Перечень основных и дополнительных диагностических мероприятий:
Перечень основных диагностических мероприятий:
Для женщины:
• определение группы крови и резус-фактора;
• клинический анализ крови, включая время свертываемости;
• анализ крови на сифилис, вирус иммунодефицита человека, гепатиты В и С;
• биохимический анализ крови (АЛТ, АСТ, билирубин, глюкоза, общий белок, мочевина, креатинин); коагулограмма (протромбиновый индекс, АЧТВ, фибриноген);
• исследование на флору из уретры и цервикального канала и степень чистоты влагалища; исследование на инфекции (хламидии, ВПГ, ЦМВ, уреаплазма, микоплазма,
• гонорея, трихомониаз, токсоплазмоз, краснуха);
• цитологическое исследование мазков шейки матки;
• определение в крови пролактина, ЛГ, ФСГ, тестостерона, ТТГ на 3-5 день менструального цикла; общий анализ мочи;
• определение в кровиантимюллеровского гормона;
• ультразвуковое исследование органов малого таза;
• ультразвуковое исследование молочных желез;
• исследование состояния матки и маточных труб методом гистеросальпингографии и/или лапароскопии;
• флюорография/обзорная рентгенография грудной клетки;
• электрокардиография;
• осмотр терапевта о состоянии здоровья и возможности вынашивания беременности с предоставлением заключения;
• справка с центра психического здоровья. Для мужчины:
• анализ крови на сифилис, ВИЧ, гепатиты В и С;
• спермограмма, морфологическое исследование эякулята;
• определение группы крови и резус-фактор;
• микроскопия мазка из уретры; Перечень дополнительных диагностических мероприятий: Для женщины:
• определение в крови эстрадиола, прогестерона, кортизола, трийодтиронина, тироксина, дегидроэпиандростендиона сульфата, обследование на наличие антиспермальных и антифосфолипидных антител; волчаночный антикоагулянт, гемостазиограмма; осмотр других специалистов по показаниям с предоставлением заключения; консультация генетика, кариотипирование;
• ультразвуковое исследование органов брюшной полости и почек;
• бактериологический посев из цервикального канала и определение чувствительности к антибиотикам;
• гистероскопия с гистологическим исследованием эндометрия; онкомаркеры.
Для мужчин:
• обследование на ЛГ, ФСГ, тестостерон, пролактин, тест на простатспецифические антитела; исследование секрета предстательной железы;
• бактериологический посев спермы (или секрета предстательной железы); • инфекционное обследование (хламидиоз, уро-и микоплазмоз, вирус простого герпеса, цитомегалия); исследование кариотипа и другие генетические исследования;
• MAR-тест (определение выключенных из оплодотворения сперматозоидов); гипоосмолярный тест и флотация спермы (при некроспермии);
• консультация уролога-андролога;
• ультразвуковое исследование органов мошонки, органов малого таза.
2.4 Требования к проведению процедуры/вмешательства:
Требование к соблюдению мер безопасности, санитарнопротивоэпидемическому режиму: согласно Санитарным правилам «Санитарноэпидемиологические требования к объектам здравоохранения», утвержденным приказом Министра здравоохранения Республики Казахстан от 31 мая 2017 года № 357. Требования к оснащению: согласно приказу и.о.Министра здравоохраненияРеспублики Казахстан от 30 октября 2009 г. № 627«Об утверждении Правил проведения вспомогательных репродуктивных методов и технологий» Техническое оснащение: согласно приказу и.о. Министра здравоохраненияРеспублики Казахстан от 30 октября 2009 г. № 627 «Об утверждении Правил проведения вспомогательных репродуктивных методов и технологий» Требования к расходным материалам: нет Требование к подготовке пациента: согласно приказу и.о. Министра здравоохраненияРеспублики Казахстан от 30 октября 2009 г. № 627 «Об утверждении Правил проведения вспомогательных репродуктивных методов и технологий»
Методика проведения процедуры/вмешательства:
При индукции суперовуляции могут использоваться следующие группы препаратов:селективные модуляторы эстрогеновых рецепторов; гонадотропины (человеческийменопаузальныйгонадотропин,фолликулостимулирующийгормон,реко мбинантный фолликулостимулирующий гормон, рекомбинантный лютеинизирующий гормон, хорионический гонадотропин/рекомбинантный); агонисты гонадотропин-рилизинг-гормона); антагонисты гонадотропин-рилизинггормона, соматотропные гормоны, антиэстрогены и другие.Режим дозирования подбирается индивидуально каждому пациенту.
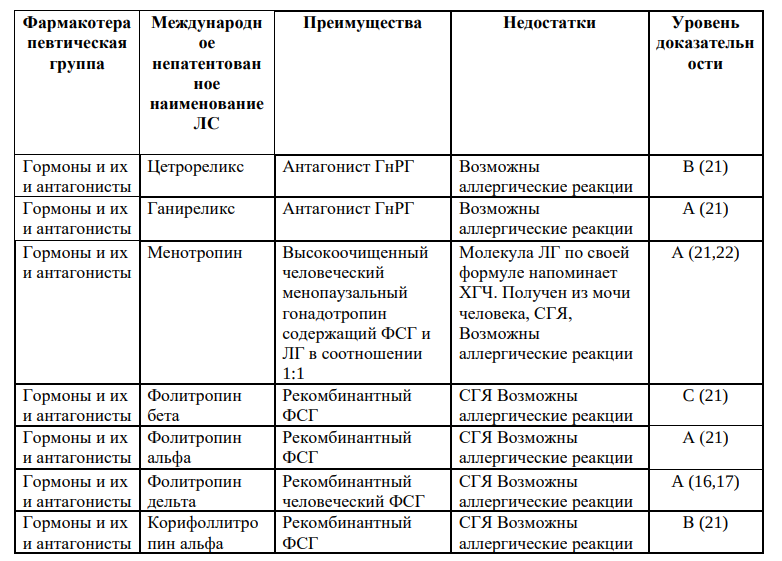
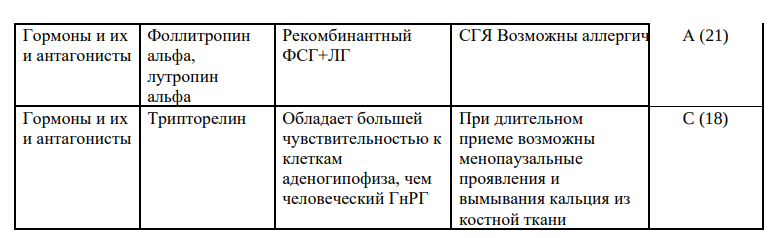
Порядок главных этапов выполнения:
• блокада гипофиза ант-ГнРГ на 6 день стимуляции (или достижения большинства фолликулов диаметра 14 мм и более);
• стимуляция суперовуляции препаратами гонадотропинами (с 1-4 дня цикла)
• введение триггера – хорионического гонадотропина или а-ГнРг за 32-36 часов до пункции; пункция яичников;
• перенос эмбрионов на 2-6-й день после пункции;
• поддержка беременности 14 дней. Осуществляется после пункции, заканчивается после того, как будет сделан контрольный ХГч 14 дней после переноса; контроль беременности по УЗИ на 21 день после переноса эмбрионов;
• общая длительность протокола примерно 20-50 дней.
Этапы проведения ЭКО:
• пункция фолликулов после стимуляции суперовуляции для получения ооцитов;
• оценка ооцит-кумулюсного комплекса; подготовка сперматозоидов для ЭКО;
• инсеминация яйцеклеток обработанной спермой; отсутствие прямых показаний к ИКСИ. Пункция фолликулов: Врачебная часть: проводят под общей анестезией,иглу проводят трансвагинально,ход иглы контролируют аппаратом УЗИ. Целью пункции является аспирация фолликулярной жидкости. Оценка ооцит-кумулюсного комплекса: Эмбриологическая часть: полученную жидкость исследуют с помощьюмикроскопа для обнаружения яйцеклеток. Визуально производится оценка ооцит-кумулюсного комплекса. Обнаруженные яйцеклетки отмывают от фолликулярной жидкости в специальной среде с буфером, и переносят в лабораторную посуду с культуральной средой. В качестве лабораторной посуды используют чашки Петри, либо культуральные планшеты. Чашки с яйцеклетками помещают в СО2-инкубаторы, в которых поддерживается температура 37-37,5 C и содержание СО2 в атмосфере 5-6 %.
Подготовка сперматозоидов для процедуры ЭКО:
• оценка качества спермы в эякуляте, используя камеру Маклера. Оценивается подвижность сперматозоидов, и проводится подсчет концентрации сперматозоидов категории А+B;
• провести обработку сперматозоидов специальными средами;
• произвести конечную оценку качества сперматозоидов в обработанной среде. Подсчитать концентрацию сперматозоидов категории А+B в камере Маклера. Инсеминация яйцеклеток обработанной спермой: день оплодотворения считается нулевым днем. Оплодотворение проводится обработанной спермой через 2-6 часа после получения яйцеклеток. Для обычного оплодотворения используется приблизительно 50 – 100 тысяч сперматозоидов на каждую яйцеклетку; чашка с яйцеклетками и сперматозоидами находятся в инкубаторе до утра следующего дня, где температура и подача СО2 выдерживаются 37-37,5o C и 5-6% соответственно. Утром следующего дня производится оценка наличия оплодотворения. Необходимые условия для проведения ИКСИ:
• получение подвижных сперматозоидов, пригодных для оплодотворения;
• наличие качественных ооцитов у женщины (зрелые ооциты, наличие первого полярного тельца);
• наличие оборудования, сред и расходных материалов для проведения ИКСИ. Показания к проведению ИКСИ:
• олигозооспермия - снижение концентрации сперматозоидов менее 15 млн./мл;
• астенозооспермия - менее 25% активноподвижных сперматозоидов в 1 мл эякулята; тератозооспермия - менее 4% сперматозоидов нормального строения;
• сочетанная патология спермы (возможно различное сочетание изменений в концентрации, подвижности и строения сперматозоидов, что значительно снижает оплодотворяющую способность спермы);
• наличие антиспермальных антител в эякуляте (MAR-тест более 50%), которые препятствуют естественному оплодотворению даже в случаях нормальной концентрации сперматозоидов; неудачные предыдущие попытки ЭКО в анамнезе. Этапы проведения ИКСИ: • пункция фолликулов после стимуляции суперовуляции для получения ооцитов;
• денудация ооцитов; подготовка сперматозоидов для ИКСИ;
• иммобилизация сперматозоида;
• аспирация сперматозоида в иглу (инжектор);
• закрепление ооцита на присоске (холдинге);
• введение сперматозоида в цитоплазму яйцеклетки. Врачебная часть: Пункцию фолликулов проводят под общей анестезией или безнее. Иглу проводят трансвагинально, ход иглы контролируют аппаратом УЗИ. Целью пункции является аспирация фолликулярной жидкости.
Эмбриологическая часть:
1) Полученную жидкость исследуют с помощью микроскопа для обнаруженияяйцеклеток. Обнаруженные яйцеклетки отмывают от фолликулярной жидкости, и переносят в лабораторную посуду с культуральной средой. В качестве лабораторной посуды используют чашки Петри, либо культуральные планшеты. Посуду с яйцеклетками помещают в СО2-инкубаторы, в которых поддерживается температура 37 -37,5° C и содержание СО2 в атмосфере 5-6 %.
2) Денудация ооцитов проводится через2-4часа после ТВП.Денудированиеооцитов следует проводить, избегая сильного механического воздействия (риск разрыва оболочки клетки, повреждение мейотического веретена деления и искусственного разделения цитоплазмы). Денудированные (очищенные) ооциты помещают в микрокапли со средой для проведения ИКСИ. Инжектирование проводится не ранее, чем через 30 минут после денудации.
3) Подготовка сперматозоидов для ИКСИ. Суспензию сперматозоидов для ИКСИдобавляют в специальные среды непосредственно перед началом проведения микроманипуляции .
4) Иммобилизация сперматозоида.Выбрать сперматозоид правильнойморфологии, и иммобилизировать его двумя-тремя поперечными движениями инъекционной пипетки, прижимая хвост ко дну чашки или с помощью лазера.
5) Аспирация сперматозоида в иглу. Сперматозоид аспирировать в иглу состороны хвоста, остановить движение жидкости в пипетке.
6) Закрепление ооцита на присоске.Переместить чашку так,чтобы капля сооцитом была в фокусе. Ооцит фиксируют присоской.
7) Введение сперматозоида в цитоплазму яйцеклетки. Инъекция сперматозоидапроводится путем введения пипетки через оболочку до середины цитоплазмы яйцеклетки. Перенести инжектированные ооциты в среду для культивирования.
8) Вспомогательный хэтчинг –методика,применяемая для улучшенияимплантации эмбрионов в эндометрий матки путем надрезания наружной оболочки. Показания к применению ВХ:
• возраст пациентки превышает 37 лет;
• повышенный базальный уровень ФСГ (> 10); предыдущие безуспешные попытки ЭКО;
• утолщенная или уплотненная наружная оболочка эмбриона. Методика проведения переноса эмбриона(ов) в полость матки. Перенос эмбрионов возможен через цервикальный канал или трансмиометрально при наличии специальными катетерами для переноса. Основная задача переноса состоит в ведении эмбриона(ов) в верхнюю треть полость матки в среде для переноса или среде дальнейшего культивирования. Для лучшего контроля процедуры, возможен контроль УЗИ. Возможен перенос не более 3 эмбрионов.
2.5 Индикаторы эффективности процедуры/вмешательства: наступление беременности, рождение здорового ребенка.
3.1 Список разработчиков протокола с указанием квалификационных данных:
1) Локшин Вячеслав Натанович – доктор медицинских наук, профессор, членкорреспондент НАН РК, президент Казахстанской ассоциации репродуктивной медицины, президент Ассоциации международных фармацевтических производителей;
2) Валиев Равиль Камилевич – кандидат медицинских наук, врач МКЦР (международный клинический центр репродукции) «Персона», г. Алматы;
3) Карибаева Шолпан Кенесовна – кандидат медицинских наук, главный врач МКЦР (международный клинический центр репродукции) «Персона», г. Алматы;
4) Рыбина Анастасия Николаевна – акушер-гинеколог I категории, врач МКЦР «Персона», г. Алматы;
5) Куздембаева Раиса Салмагамбетовна–доктор медицинских наук, профессор, академик Национальной Академии наук РК, академик Академии профилактической медицины, главный клинический фармаколог РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» МЗ РК.
3.2 Указание на отсутствие конфликта интересов: нет.
3.3 Рецензенты: Утепова Гульнара Тлеулесовна – кандидат медицинскихнаук, врач высшей категории, заведующая отделения ЭКО АО «Национальный научный центр материнства и детства»
3.4 Список использованной литературы:
1) Кодекс Республики Казахстан о здоровье народа и системе здравоохранения 18 сентября 2009 года (с изменениями и дополнениями по состоянию на 27.04.2012) № 193-IV ЗРК
2) Кодекс Республики Казахстан от 26 декабря 2011 года № 518-IV «О браке (супружестве) и семье».
3) Приказ МЗ РК № 627 от «30» октября 2009 года «Об утверждении Правил проведения вспомогательных репродуктивных методов и технологий»
4) Приказ МЗ РК № 162 от «30» марта 2011 года «Об изменениях и дополнениях в Приказ №627».
5) Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях. Боярский К.Ю., Гайдуков С.Н.Журнал акушерства и женских болезней, том LVIII, №3, 2009 г, стр. 75-85.
6) Оценка частоты, морфологической и микробиологической структуры хронического эндометрита у пациенток с трубно-перитонеальной формой бесплодия и неудачными попытками экстракорпорального оплодотворения. Гинекология №3. Том 11. 2009г. Феоктистов А.А., Овсянникова Т.В., Камилова Д.П.
7) Современные аспекты патогенеза и лечения эндокринного бесплодия. И.В. Загребельная. Международный медицинский журнал. 2010 г №1.
8) Синдром поликистозных яичников. Тактика лечения бесплодия у пациенток с СПКЯ. О.Ф.Серова, Н.В.Зароченцева. Гинекологическая эндокринология. Том7, №9. 2005г.
9) К вопросу обеспечения мониторинга гормонального статуса женщин. В.В. Каминский, С.И. Жук, Н.А. Синенко, А.В. Каминский. Репродуктивное здоровье женщины. 2(36)2008г.
10) Тактика ведения больных с синдромом «пустых» фолликулов в программах экстракорпорального оплодотворения. Палиева Наталья Викторовна. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. 2005 г.
11) Модифицированный протокол циклов ЭКО у женщин со сниженным овариальным резервом. А.М.Феськов, В.В.Лазуренко, О.В.Мерцалова, И.А.Феськова. УДК:618.177-02:616.43:611
12) Совершенствование методов диагностики и лечения в гинекологии. Кудайбергенов Т.К., Султанова Ж.У., Манасова И.К. Актуальные проблемы акушерства, гинекологии и перинатологии. Алматы 2007. стр. 177-178.
13) Особенности вспомогательных репродуктивных технологий при некоторых гинекологических заболеваниях. Локшин В.Н. Актуальные проблемы акушерства, гинекологии и перинатологии. Алматы 2007. стр. 185-187.
14) Неполноценная лютеиновая фаза – тактика ведения пациенток с привычной потерей беременности Сидельникова Н.М. Гинекология.– 2002.– №4.
15) Controlled Ovarian Stimulation with recombinant-FSH plus recombinant-LH vs.human Menopausal Gonadotropin based on the number of retrieved oocytes: results from a routine clinical practice in a real-life population. Revelli A1,2, Pettinau G3 , Basso G4 , Carosso A5 , Ferrero A6 , Dallan C7 , Canosa S8 , Gennarelli G9,10, Guidetti D11, Filippini C 12, Benedetto C13. Reprod Biol Endocrinol. 2015 Jul 25;13:77. doi: 10.1186/s12958-015- 0080-6
16) Individualization of the starting dose of follitropin delta reduces the overall OHSS risk and/or the need for additional preventive interventions: cumulative data over three stimulation cycles. Anders Nyboe Andersen, M.D., Ph.D.,a Scott M. Nelson, M.R.C.O.G., Ph.D.,b Bart C. J. M. Fauser, M.D., Ph.D.,c Juan Antonio García-Velasco, M.D., Ph.D.,d Bjarke M. Klein, Ph.D.,e and Joan-Carles Arce, M.D., Ph.D.,f for theESTHER-1 study group. Fertility and Sterility® Vol. 107, No. 2, February 2017 0015-0282.
17) Follitropin delta in repeated ovarianstimulation for IVF: a controlled,assessor-blind Phase 3 safety trial. Ernesto Bosch1,*, Jon Havelock2 , Fernando Sánchez Martin3 ,BirgitteBuur Rasmussen4 , Bjarke Mirner Klein5 , Bernadette Mannaerts6 ,JoanCarles Arce6 , for the ESTHER-2 Study Group.Published by Elsevier Ltd on behalf of Reproductive Healthcare Ltd. This is an open access articleunder the CC BY-NC-ND license. (http://creativecommons.org/licenses/by-nc-nd/4.0/)
18) Guideline of the European Society of Human Reproduction and Embryology “Ovarian stimulation for IVF/ICSI”, 2019 (https://www.eshre.eu/Guidelines-andLegal/Guidelines/Ovarian-Stimulation-in-IVF-ICSI)